
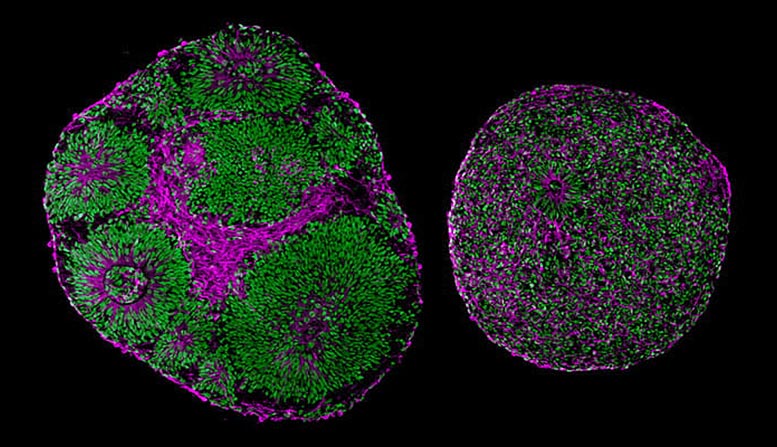
As micrografias revelam diferenças significativas em tamanho e estrutura entre organelas cerebrais derivadas de um paciente com síndrome de Pitts Hopkins (direita) e um controle (esquerda). Crédito: Universidade da Califórnia, San Diego Health Sciences
O estudo da Universidade da Califórnia em San Diego (UCSD) usa tecido cerebral humano cultivado em laboratório para identificar anormalidades neurológicas na síndrome de Pitt Hopkins e testar ferramentas de terapia genética.
Em um estudo publicado em 2 de maio de 2022 na revista Comunicações da NaturezaCientistas da Escola de Medicina da Universidade da Califórnia, em San Diego, usaram organoides do cérebro humano para descobrir como uma mutação genética associada ao autismo grave interrompe o neurodesenvolvimento. O uso de ferramentas de terapia gênica para restaurar a função do gene resgatou com sucesso a estrutura e a função neuronal.
Várias doenças neurológicas e neuropsiquiátricas, incluindo transtornos do espectro do autismo (TEA) e esquizofrenia, têm sido associadas a mutações no fator de transcrição 4.TCF4), um gene essencial no desenvolvimento do cérebro. Os fatores de transcrição regulam quando outros genes são ativados ou desativados, de modo que sua presença ou ausência pode ter um efeito dominó no feto em desenvolvimento. No entanto, não se sabe muito sobre o que acontece com o cérebro humano quando isso ocorre. TCF4 mutado.
Para explorar essa questão, os pesquisadores se concentraram na síndrome de Pitts Hopkins, um transtorno do espectro do autismo causado por mutações em TCF4. As crianças com a condição hereditária apresentam deficiências cognitivas e motoras profundas e geralmente não são verbais.
Síndrome de Pitt Hopkins (PTHS) é uma doença genética rara caracterizada por atraso no desenvolvimento, epilepsia, características faciais distintas e hiperventilação potencialmente intermitente seguida de apnéia. À medida que se descobre mais sobre Pitt Hopkins, o espectro de desenvolvimento do transtorno se expande para incluir autismo, ansiedade, TDAH e distúrbios sensoriais. Está associado a um defeito no cromossomo 18, especificamente a expressão insuficiente do gene TCF4.
Os modelos de camundongos existentes da síndrome de Pitt Hopkins não conseguem imitar com precisão as características neurológicas dos pacientes, então a equipe da UCSF criou um modelo de pesquisa em humanos para o distúrbio. Usando a tecnologia de células-tronco, eles transformaram as células da pele dos pacientes em células-tronco, que foram então desenvolvidas em organelas cerebrais tridimensionais, ou “mini-cérebros”.
Observações iniciais de organoides cerebrais revelaram um grande número de diferenças estruturais e funcionais entre TCF4Amostras mutagênicas e seus controles.
Estudo autor sênior Alison R. Mottery, Ph.D., professor da UCSD School of Medicine, diretor do UCSD Stem Cell Program, e um membro do Sanford Consortium for Regenerative Medicine disse.
o TCF4As organelas mutantes eram muito menores do que as organelas normais, e muitas das células não eram realmente neurônios, mas progenitores neuronais. Essas células simples deveriam proliferar e depois amadurecer em células cerebrais especializadas, mas nas organelas mutantes, parte desse processo deu errado.
Uma série de experimentos revelou que TCF4 Um boom levou a uma interrupção no curso do rio SOX Os genes e a via Wnt, dois importantes sinais moleculares que guiam as células embrionárias para se multiplicarem, amadurecerem em neurônios e se moverem para o local correto no cérebro.
Devido a esse desequilíbrio regulatório, as linhagens neuronais não proliferaram eficientemente e, portanto, menos neurônios corticais foram produzidos. As células que já haviam amadurecido em neurônios eram menos excitáveis do que o normal e muitas vezes se mantinham agrupadas em vez de se organizarem em circuitos neurais bem ajustados.
Essa estrutura celular atípica interrompeu o fluxo de atividade neural nas organelas cerebrais mutantes, o que os autores disseram que provavelmente contribuiria para a função cognitiva e motora prejudicada.
“Ficamos surpresos ao ver problemas de desenvolvimento tão importantes em todos esses níveis diferentes, e isso nos deixou imaginando o que podemos fazer para resolvê-los”, disse o primeiro autor Fabio Papez, PhD, professor associado da Universidade de Campinas e pesquisador visitante da UCLA . San Diego School of Medicine, que supervisionou conjuntamente o trabalho com Muotri. Papes tem um parente que sofre da síndrome de Pitts Hopkins, o que o levou a estudar TCF4.
A equipe testou duas estratégias diferentes de terapia genética para restaurar um gene funcional no tecido cerebral. Ambos os métodos aumentaram efetivamente TCF4 Ao fazer isso, os fenótipos da síndrome de Pitt Hopkins foram corrigidos nos níveis molecular, celular e eletrofisiológico.
“O fato de que podemos corrigir esse gene e que todo o sistema nervoso está se restabelecendo, mesmo em nível funcional, é incrível”, disse Mootri.
Mootri observa que essas intervenções genéticas ocorreram no estágio pré-natal do desenvolvimento cerebral, enquanto em um ambiente clínico, as crianças receberiam seu diagnóstico e tratamento alguns anos depois. Assim, os ensaios clínicos devem primeiro confirmar se uma intervenção subsequente ainda é segura e eficaz. A equipe está atualmente refinando ferramentas de terapia genética recentemente licenciadas em preparação para esse teste, no qual se espera que a injeção de backbone do vetor do gene restaure a função do TCF4 no cérebro.
“Para essas crianças e seus entes queridos, vale a pena tentar qualquer melhora na função cognitivo-motora e na qualidade de vida”, disse Mootri.
“A coisa realmente especial sobre este trabalho é que esses pesquisadores vão além do laboratório e estão trabalhando muito para tornar essas descobertas traduzíveis para a clínica”, disse Audrey Davido, presidente da Pitt Hopkins Foundation for Research. “Este é muito mais do que um excelente artigo acadêmico; é uma verdadeira medida do que a ciência bem experiente pode alcançar na esperança de mudar a vida humana para melhor.”
Referência: “A perda do fator de transcrição 4 está associada a déficits na proliferação de progenitores e conteúdo de neurônios corticais” por Fabio Papis, Antonio B. Camargo, Janina S. De Souza, Vinicius MA, Carvalho, Ryan A. Seto, Irene Lamontani, Jose R. Teixeira, Simone H. Avancini, Sandra M. Sanchez Sanchez, Thiago S. Nakahara, Carolina N. Santo, Wei Wu, Hang Yao, Barbara M. P. Araujo, Paolo Enf Filho, and Gabriel J. , 2 de maio de 2022, Comunicações da Natureza.
DOI: 10.1038 / s41467-022-29942-w
Os coautores são: Janina S. de Souza, Ryan A. Sito, Irene Lamontani, Simone H. Avancini, Sandra M. Sanchez Sanchez, Wei Wu, Hang Yao e Gabriel Haddad da UCSD; António B. Camargo, Vinicius MA Carvalho, José R Teixeira, Thiago S. Nakahara, Carolina N Santo, Barbara MB Araujo e Paulo Enf Filho da Universidade Estadual de Campinas.
Este trabalho foi financiado em parte pelo National Institutes of Health (bolsa R01 MH123828), Pitts Hopkins Foundation for Research, São Paulo Research Foundation (bolsas 2020/11451-7, 2018/03613-7, 2018/04240-0) e o Joint Genome Institute do Ministério da Saúde. American Energy (DE-AC02-05CH11231).
Divulgações: Alison R. Mootri é cofundadora da TISMOO, empresa dedicada à análise genética e organogênese do cérebro humano e possui participação acionária.

“Criador. Viciado em mídia social que gosta de hipster. Fã da web. Fanático por álcool apaixonado.”










More Stories
A Boeing pode não conseguir operar o veículo Starliner antes que a estação espacial seja destruída
Vivendo com ansiedade: conselhos de especialistas sobre como aceitar um problema de saúde mental
Nova pesquisa sobre uma enorme falha de impulso sugere que o próximo grande terremoto pode ser iminente